概要
化学プラントにおいて常圧~減圧の気液平衡は、数多く取り扱う系であり、様々な物質の組み合わせが考えられます。
この記事では気液平衡の推算モデルをいくつか紹介します。
なおかつ代表的な2成分について各モデルで計算し、推算精度を比較してみました。
推算モデルの紹介
主に1atm以下の低圧系で使用される気液平衡モデルを紹介します。
状態方程式(EOS)モデル
あまり知られていないかもしれませんが、状態方程式モデルで気液平衡を計算できます。
ただ、適用範囲が狭く、液の非理想性が高い系にはまったく適用できません。
理想気体に近いような系であれば実用に耐えうると思います。
実用的な状態方程式はvan der Waals型の
Redlich Kwong(RK)
Redlich Kwong Soave(RK-SOAVE)
Peng Robinson(PR)
3種類が挙げられます。
Virial型の状態方程式はvan der Waals型に比べて式が複雑なので、あまり使われません。
Raoultの法則(IDEAL)
活量係数γの補正をせずに、Raoultの法則そのままで計算する方法です。
実測データと比較して問題なければ使用されることがあります。
Margulesの式
Margulesの式は簡単なので練習問題とかには使用されるかもしれません。
多成分系への拡張ができないので実務で使うことはないです。
van Laarの式
van Laarの式はMargulesの式と同様に多成分系への拡張ができないので実務で使うことはないです。
Wilsonの式
Wilsonの式は多成分系への適用ができるモデルの中では一番簡単な式です。
液液平衡を計算できない欠点はありますが、意外に精度が良いです。
NRTL式
NRTL式は多成分系への適用ができ、液液平衡も計算できる汎用性の高い式です。
実務では最も使用頻度が高いです。
UNIQUAC式
UNIQUAC式は系によってはNRTL式より若干精度が上がる気がします。
ですがWilson、NRTLと精度が変わらないことも多いです。
UNIFAC式
UNIFAC式は気液平衡の実測データがない場合は使用することがあります。
推算精度はWilson、NRTLに少し劣るかな、というところです。
各モデルの比較
この記事では低圧気液平衡でよく登場する4つのケースについて、各モデルで気液平衡計算した結果を比較しました。
計算したモデルは
・状態方程式モデル(RK-SOAVE)
・IDEAL
・Wilson
・NRTL
・UNIQUAC
・UNIFAC
上の6種類です。
Margulesとvan Laarは普段使わないので省きました。
なお、すべてのケースで圧力は1atmとしました。
理想系に近い組み合わせ(ベンゼン-トルエン)
まずは理想系に近い組み合わせを計算しました。
ベンゼン-トルエンの2成分系です。
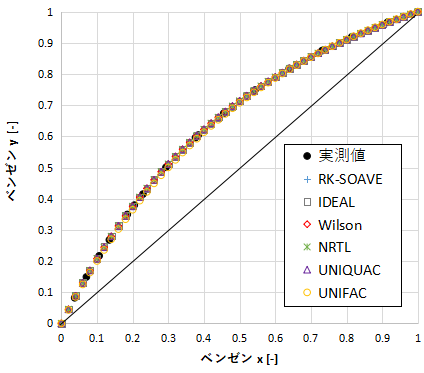
上のグラフは縦軸にベンゼンの気相組成y、横軸にベンゼンの液相組成xをとったxy線図です。
すべてのモデルが実測値と良好に一致していますね。
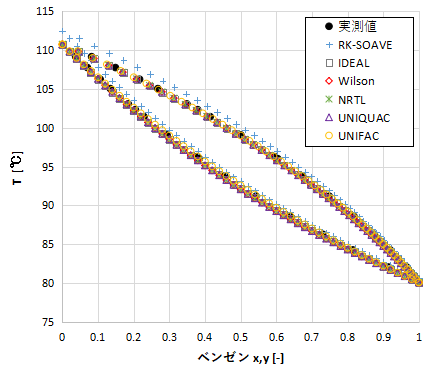
また、もう一つのグラフは縦軸に温度T、横軸にベンゼンの液相組成x、気相組成yを両方プロットしたTxy線図です。
RK-SOAVEのみ少しずれていますが、それ以外のモデルは良好に一致しています。
RK-SOAVEはよく見るとトルエンの沸点(x=0)がずれていますね。
RK-SOAVE以外のモデルはAntoine式を使用して純物質の蒸気圧を計算しているので、同じ沸点となっていますが、状態方程式モデルは純物質の蒸気圧をAntoine式を使わず自分で計算するのでずれが生じています。
逆に言えば状態方程式モデルは、純物質の蒸気圧パラメータがなくても計算できるというメリットがあります。(ただし精度が良いとは限りません。)
極性のある組み合わせ(エタノール-水)
次は極性のある組み合わせを計算しました。
エタノール-水の2成分系で、最低共沸が存在することで知られています。
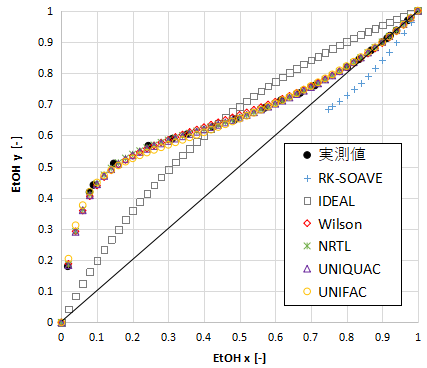
エタノールに関するxy線図を示します。
RK-SOAVEとIDEALは大きくずれていますね。
極性のある系は活量係数で補正しないと合わせるのは難しいです。
Wilson、NRTL、UNIQUAC、UNIFACはどれも良好に一致しています。
強いて言うならUNIFACが少しずれているかな、という程度です。

次にTxy線図を示します。
この図ではわかりづらいですが、エタノール-水の混合物は1atmで78.2℃が最低共沸点となります。
x-y線図と同様にWilson、NRTL、UNIQUAC、UNIFACはどれも良い精度で実測値と一致しています。
最高共沸を示す組み合わせ(アセトン-クロロホルム)
次は最高共沸を示す組み合わせについて計算しました。
アセトン-クロロホルムの2成分系です。
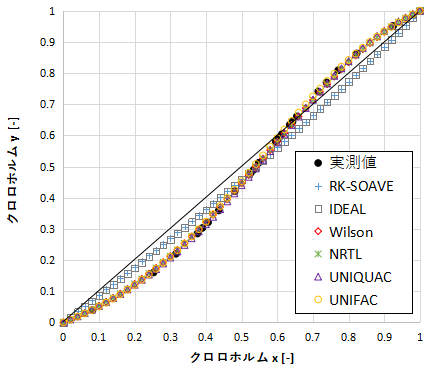
クロロホルムに関するxy線図を示します。
RK-SOAVEとIDEALは少しずれていますが、他のモデルは実測値とほぼ一致しています。
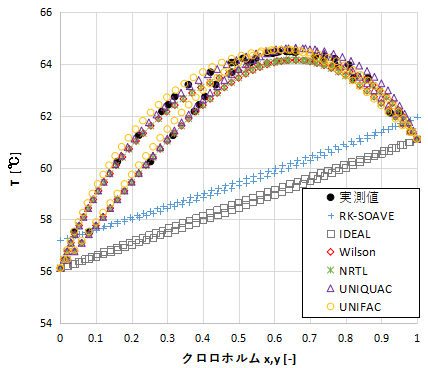
次にTxy線図を示します。
アセトン-クロロホルムの混合物は1atmで64.4℃が最高共沸点となります。
xy線図ではRK-SOAVEとIDEALは少しずれている程度でしたが、Txy線図ではあてにならないくらいずれていますね。
このように片方のグラフだけでモデルの精度を判断するのは危険ですので、必ず複数のグラフ(xy線図、Txy線図、Pxy線図)で気液平衡関係を確認しましょう。
Wilson、NRTL、UNIQUAC、UNIFACの中ではUNIFACが少しずれているでしょうか。
液液平衡が存在する組み合わせ(メチルエチルケトン-水)
最後に液液平衡を含む、いわゆる気液液平衡関係を比較しました。
メチルエチルケトン(以下MEK)-水の2成分系です。
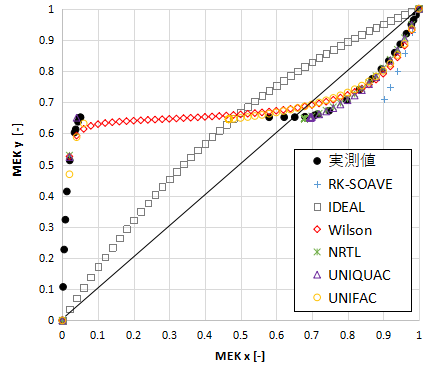
MEKに関するxy線図を示します。
実測値がx=0.05~0.55まで途切れているのは、液液平衡のためです。
RK-SOAVEとIDEALは同様にずれが大きいです。
加えて今回はWilsonも液液平衡を計算できず、液液平衡(x=0.05~0.55)の区間も値が連続的に計算されてしまっています。
Wilsonが液液平衡を計算できない理由については下の記事で紹介しています。
-

Wilson式が液液分離を計算できない理由
活量係数を算出する手法の1つであるWilson式は2液相分離する系に適用できないことが一般的に知られています。ですが、なぜ適用できないのかきちんと確認したことがある人は少ないのではないでしょうか。
本記事ではWilson式の2液相への適用可否について紹介します。続きを見る
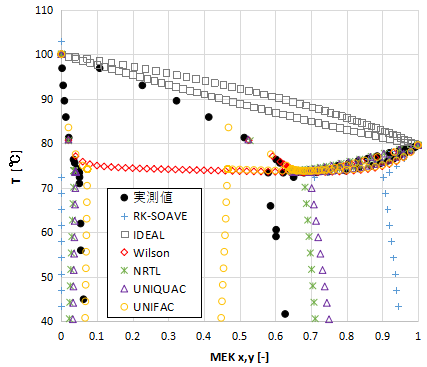
次に気液平衡と液液平衡の両方を含めて、Txxy線図を示します。
縦軸の温度について、約75℃以上の領域が気液平衡で、75℃以下が液液平衡を表わしており、それぞれの平衡関係がくっついたような線図となっています。
まず意外なのはRK-SOAVEが液液平衡も計算している点です。まったく合ってはいませんが、理論的には計算できるのです。
気液平衡の領域(75℃以上)に関してはNRTL、UNIQUAC、UNIFACはよく一致しています。
しかし液液平衡(75℃以下)の領域はどのモデルも実測値とのずれが生じていますね。
それだけ気液液平衡を完璧に合わせるのは難しい、ということを覚えておきましょう。
まとめ
今回はAspen Plusにもともと内蔵されている2成分パラメータを使用して比較しました。
シミュレータ内蔵の2成分パラメータでずれるところは、実測値を使用してフィッティングすることで精度を上げます。

