概要
Raoultの法則を非理想溶液に適用するための補正係数を活量係数γといいます。
$$p_{i}=P_{i}x_{i}γ_{i}$$
pi:i成分の分圧、Pi:第i成分が単独で存在するときの蒸気圧
xi:第i成分のモル分率、γi:i成分の活量係数
γは成分それぞれに適用されるため、第1成分の活量係数はγ1、第2成分の活量係数はγ2、第i成分の活量係数はγiとなります。
非理想溶液の分圧を計算するためには、各成分の活量係数γを算出する必要があります。
活量係数の物理的意味合い
まず前提として理想溶液であればどのような組成であってもγ=1となり、Raoultの法則と同じ式になります。
非理想溶液ではγが1以外の値を示し、かつ組成によってγが変化します。
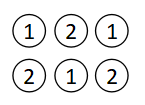
上図のような2成分系を例として挙げます。
まず第1成分と第2成分の分子が均等に配置されているケースを考えます。
この場合は第1成分から第2成分への相互作用と第2成分から第1成分への相互作用が同じとなるので、γ1=γ2となることが知られています。
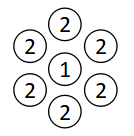
次にx1→0、つまり第1成分の濃度が限りなく薄くゼロに近いケースを考えます。
この場合は数少ない第1成分が第2成分に囲まれている状態になっており、第1成分の非理想性は最も高くなります。
したがってx1→0のときがγ1が最大となります。
一方で第2成分は回りを同じ第2成分で囲まれた状態にあるので、非理想性はまったくありません。
そのためx1→0のときはγ2=1となります。
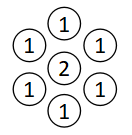
最後にx2→0、つまり第2成分の濃度が限りなく薄くゼロに近いケースを考えます。
この場合は第1成分と同様のことが第2成分にも起こります。
x2→0のときγ2が最大となり、γ1=1となります。
このように活量係数γはその系の非理想性の度合いを数字で表して補正する役割を果たしています。
また、活量係数γは1より大きくなる系と1より小さくなる系に大きく分かれます。
1より大きくなる場合は概要の式から、分圧が大きくなるように補正されます。そのような系は分子間に斥力が働いたため蒸気圧が大きくなったと考えられます。
逆に1より小さくなる場合は分圧が小さくなるように補正されるため、分子間に引力が働いたと考えられます。
例:メタノール-水系の活量係数
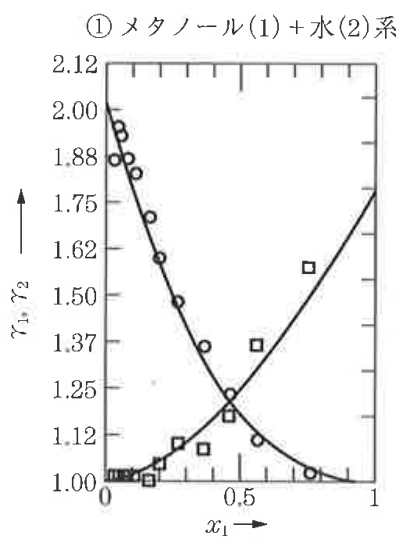
例としてメタノール-水系の活量係数のグラフを示します。
縦軸のγ1はメタノールの活量係数、γ2は水の活量係数で、単調減少の曲線がγ1、単調増加のグラフがγ2です。
横軸はメタノールの液組成で0から1まで変化したときに活量係数がどう変化するかをプロットしています。
x1≒0のときは前述したようにメタノール分子が水分子に囲まれた状態なのでγ1が最大値となり、γ2が1となっています。
x2≒1のときは逆にγ2が最大となり、γ1が1となっています。
また、x1≒0のときのγ1の値、x2≒1のときのγ2の値は実は活量係数を算出するうえで重要な値となっています。
これらの値のことを特に無限希釈活量係数といいます。
どちらかの成分を無限に近いくらい希釈したときの活量係数を意味します。
実務では無限希釈活量係数は物性系の参考資料から値を拾ってくるか、シミュレーターに内蔵された値を使用することが多いです。
データがない場合は2成分の組成を変えて実験を行ないデータを取ります。
上図のようにプロットから曲線を引き、x1=0、x1=1に外挿して無限希釈活量係数を算出します。
活量係数の算出式
徐々に記事にしていきます。
-

【Margules式】を解説:2成分系活量係数モデル
Margules(マーギュラス)が提案した活量係数を算出する式のことをMargulesの式といいます。Margulesは活量係数を多項式の形で表せるとしました。
続きを見る
-

【van Laar式】を解説:2成分系活量係数モデル
var Laarの式はvan der Waalsの状態方程式をベースに提案されたと言われています。Margules式と同様に3成分以上の系に適用できないのが難点です。
続きを見る
-

【Wilson式】を解説:多成分系活量係数モデルの先駆け
Wilsonの式とは活量係数を算出する手法の1つであり、3成分以上の多成分系に適用できる式です。2液相分離する系には適用できないデメリットがあるものの、それ以外の系には良い精度で適用できます。
続きを見る
-

【NRTL式】を解説:汎用的で使用頻度の高い活量係数モデル
NRTL式とは活量係数を算出する手法の1つであり、Wilsonの式と同様に3成分以上の多成分系に適用できる式です。Wilsonの式とは違い2液相分離する系にも適用できるため汎用性の高い手法です。
続きを見る
-

【UNIQUAC式】を解説:活量係数が1より小さい系に適用可
UNIQUAC(Universal Quasi Chemical)式とは活量係数を算出するモデルの1つです。活量係数モデルの中では比較的新しく、1975年に提案されています。
続きを見る
-

【UNIFAC式】を解説:分子構造から活量係数を推算
UNIFAC(Universal Functional Group Activity Coefficient)式とは活量係数を算出するモデルの1つです。UNIFAC式は原子団寄与法と呼ばれており、分子構造の加算性を利用して活量係数を推算する方法です。
続きを見る






