概要
ある2成分において、温度を一定とした場合の液相組成x、気相組成y、圧力Pの関係を表わすグラフのことをPxy線図といいます。
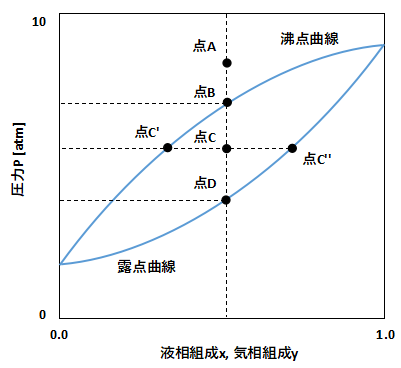
上図のように縦軸に圧力P、横軸に液相組成xと気相組成yをプロットしたグラフがPxy線図です。
図の上側の線は沸点曲線といい、混合液が蒸発し始める圧力を表わしています。
図の下側の線は露点曲線といい、混合ガスが凝縮し始める圧力を表わしています。
一般的に圧力が高い方が物質は液に凝縮しやすく、圧力が低いと蒸発して気体になりやすいです。
したがって図の点Aは沸点曲線より上側にあるため、液の状態となります。
点Aから圧力を下げていき、点Bに達すると液が蒸発し始めます。
この点Bがその圧力、温度、組成における混合物の沸点となります。
さらに圧力を下げて点Cに達すると、液体と気体の混合状態となります。
どのような組成で液体と気体に分かれるかは、てこの原理に従います。
上図で言うと、液相組成は点C'、気相組成は点C’’となります。
さらに圧力を下げて点Dに達すると、完全に液が蒸発し終わります。
この点Dがその圧力、温度、組成における混合物の露点となります。
このように圧力と混合物の状態は密接に関係があるため、特に圧力が変化する系ではPxy線図でどのような傾向となっているか確認します。
ラウールの法則に従う場合
2成分系がラウールの法則に従う理想溶液の場合は、Pxy線図の沸点曲線が直線になります。
覚えておくと、Pxy線図の形だけで理想系かどうか判断できるので便利です。
この関係はドルトンの法則とラウールの法則から導出できます。
ドルトンの法則とラウールの法則を組み合わせることで、
$$Py_{A}=x_{A}P_{A}^{o}・・・(1)$$
$$Py_{B}=x_{B}P_{B}^{o}・・・(2)$$
P:全圧、PAo:成分Aの純物質蒸気圧、PBo:成分Bの純物質蒸気圧
yA:成分Aの気相モル分率、yB:成分Bの気相モル分率
xA:成分Aの液相モル分率、xB:成分Bの液相モル分率
上の2式が成り立ちます。
辺々足し合わせると、
$$P(y_{A}+y_{B})=x_{A}P_{A}^{o}+x_{B}P_{B}^{o}$$
ここで、
$$y_{A}+y_{B}=1・・・(3)$$
$$x_{A}+x_{B}=1・・・(4)$$
(3)、(4)式の2成分の組成の関係を利用し、
$$P=x_{A}P_{A}^{o}+P_{B}^{o}(1-x_{A})$$
$$P=(P_{A}^{o}-P_{B}^{o})x_{A}+P_{B}^{o}・・・(5)$$
(5)式へと変形できます。
Pxy線図では定温であり、Antoine式のような蒸気圧の算出式は温度の関数であることから、(5)式において蒸気圧PAo、PBoは一定値となります。
したがって、(5)式は圧力Pに対するxAの一次関数となり、Pxy線図上では直線となるわけです。
